PD-1开发热度不减 新剂型新疗法备受期待
- 2022-03-14 08:44:57
- 品牌
 |
|
|
□ 王莹
近年来,PD-1相关研究掀起了肿瘤治疗领域的巨大变革,目前国内外已有多款PD-1产品上市,涉及多个肿瘤适应症。
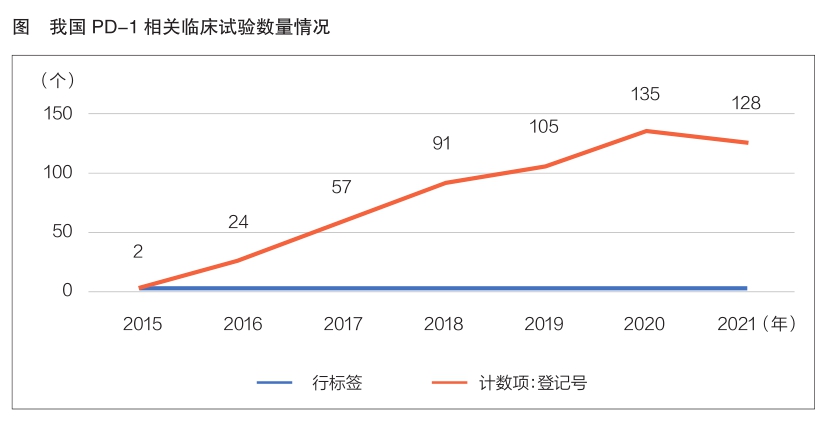
药智网数据显示,截至2021年12月14日,全球PD-1临床试验总数已达3441项,其中我国为542项(已在国家药监局药品审评中心登记),占比15.8%。全球PD-1临床试验数量从2012年开始飞速增长,并在2016—2020年间达到相对稳定的高峰,2021年开始有所下降。我国相关临床研究虽起步较晚,但发展势头迅猛,PD-1临床试验数量在2020年达到高峰,共135项(详见图)。我国已开展的542个PD-1临床试验涉及申办单位91家;涉及药品122个,生物制品最多;涉及临床试验机构64家,其中北京肿瘤医院开展临床试验数量最多,共73项;已完成的临床试验共计26项,完成Ⅲ期临床试验4项。
开展PD-1临床试验数量排名前十的国家分别是美国、中国、日本、法国、韩国、英国、新西兰、德国、澳大利亚和西班牙,其中美国和中国占比明显超过其他国家。排名前十的医药企业/机构依次是百时美施贵宝、默沙东、罗氏、阿斯利康、美国国家癌症研究所、得克萨斯大学安德森癌症中心、纪念斯隆-凯特琳癌症中心、小野制药、丹娜-法伯癌症研究所、三星医院。
全球PD-1临床试验研究排名前十的适应症依次是非小细胞肺癌、黑色素瘤、肝细胞癌、膀胱癌、肾细胞癌、肺癌、食管鳞状细胞癌、食道癌、晚期实体瘤和乳腺癌。其中,非小细胞肺癌的占比最高,为5.2%。
“O”药和“K”药是PD-1界的“明星”。由百时美施贵宝和小野制药联合开发的“O”药纳武单抗(商品名为Opdivo)于2014年7月获日本独立行政法人医药品医疗机器综合机构(PMDA)批准上市,并在2018年6月在我国获批上市。默沙东开发的“K”药帕博利珠单抗(商品名为Keytruda)于2014年9月获美国食品药品管理局(FDA)批准上市,并于2018年7月在我国获批上市。
在我国,江苏恒瑞的PD-1研究数量遥遥领先于其他申办方;信达生物开发的首个国产PD-1抗肿瘤药物信迪利单抗于2018年12月获得国家药监局批准,用于治疗复发或难治性霍奇金淋巴瘤。我国PD-1研究Top10的适应症分别是晚期实体瘤、晚期恶性肿瘤、非小细胞肺癌、晚期肝细胞癌、肝细胞癌、广泛期小细胞肺癌、晚期非小细胞肺癌、复发或难治性经典型霍奇金淋巴瘤、三阴性乳腺癌和尿路上皮癌。其中,晚期实体瘤的占比最高,为6.3%。
截至目前,我国共批准10余个PD-1类生物制品(包含同一药品的不同规格)上市,涉及2个剂型(注射剂和粉针剂)、11家企业。其中,上海君实生产的用于治疗黑色素瘤的特瑞普利单抗,百济神州生产的用于治疗经典型霍奇金淋巴瘤和局部晚期或转移性尿路上皮癌的替雷利珠单抗,江苏恒瑞生产的用于治疗经典型霍奇金淋巴瘤、晚期肝癌、局部晚期或转移性食管鳞癌的卡瑞利珠单抗,均属于乙类医保范畴。
药智网数据显示,默沙东的帕博利珠单抗为PD-1领域销售冠军。该药在2014年获批之后,2015年销售额同比猛增942.9%,2020年销售额同比增长23.18%。笔者推测,该药年销售额的增长或与其在2014年、2015年、2018年分别在美国、欧洲、中国获批上市有较大关系。
累计销售额排名第二、第三的分别是百时美施贵宝的纳武单抗、罗氏的阿特珠单抗。总体来看,PD-1相关生物制品整体呈现出在获批后销售额猛增,而后逐年大幅度下降的趋势。
当前全球PD-1临床研究热度不减,未来市场竞争必然更加激烈。笔者认为,单抗与其他靶向药物联用、开发双抗和三抗,甚至开发新的靶点,以及将目前单抗的注射剂改为口服剂型等,可能是未来的发展之路。期待更多疗效更好、更安全的抗肿瘤药物问世,造福更多患者。
本文地址:http://www.cnzhilian.com/pinpai/2022-03-14/575188.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 上一篇:新技术相继涌现 偶联药物研发迎热潮
- 下一篇:返回列表
- PD-1开发热度不减 新剂型新疗法备受期待2022-03-14 08:44:57
- 新技术相继涌现 偶联药物研发迎热潮2022-03-14 08:44:41
- 募资总额超千亿港元 强劲势头略有放缓2022-03-14 08:44:30
- 重视患者术后恢复 合理使用镇痛药物2022-03-14 08:44:04
- 【“身边最美药师”风采录 药师在线】李勇 力求把服务做到极致2022-03-14 08:43:44
-

 国际学术期刊发文证实: 预防服用连花清瘟可降低新冠阳性率和发热率
国际学术期刊发文证实: 预防服用连花清瘟可降低新冠阳性率和发热率
2022-03-08
-

 什么是阴痛?
什么是阴痛?
2021-10-26
-
美立方国内外专家齐聚 颌面专家团再升级
2021-08-23 11:47:40
-
《热点聚焦》医疗机构内新冠病毒感染防控有了新要求
2021-09-15 20:00:10
-
浙大一院2021年中秋节、国庆节放假及工作安排
2021-09-12 14:00:03
-
什么是阴结?
2021-10-26 10:33:42
-
名医风采 美立方颌面国际专家团,轮廓改造天团
2021-08-23 11:48:32
文章排行榜
- 周排名
- 月排名

